„Neustart“ für den Energiestoffwechsel – Hoffnung für Menschen mit seltenen Erkrankungen
01.03.2024
Der Einsatz bereits zugelassener Medikamente lässt auf neue Wege zur Behandlung seltener Erkrankungen wie des Leigh-Syndroms hoffen. Dies zeigen die Arbeiten im Forschungskonsortium CureMILS, die zu ersten erfolgreichen Behandlungen führten.
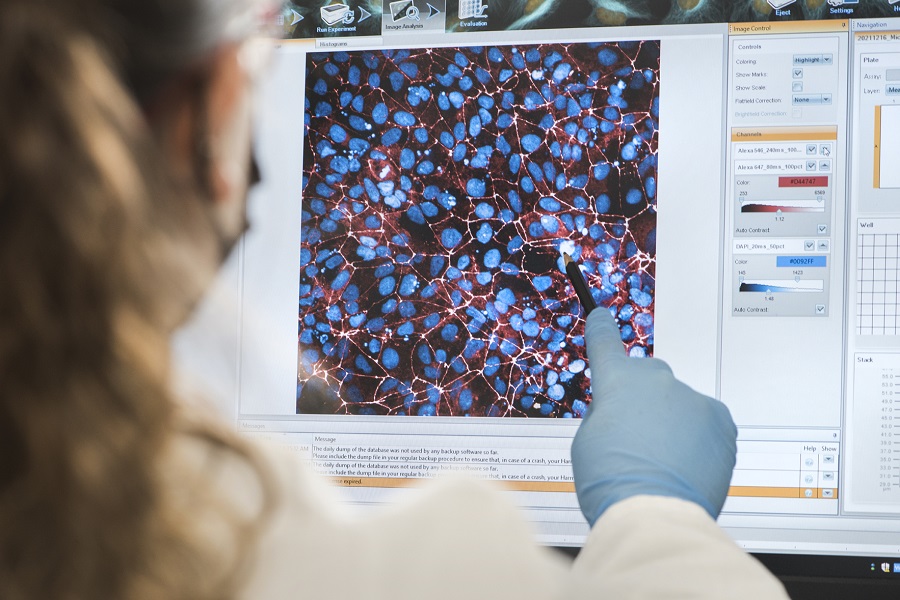 Auswertung von Bilddaten des Hochdurchsatz-Wirkstoffscreenings in MILS-Patientenzellen |© Fraunhofer ITMP/Martin Kunze
Auswertung von Bilddaten des Hochdurchsatz-Wirkstoffscreenings in MILS-Patientenzellen |© Fraunhofer ITMP/Martin Kunze
Ohne Mitochondrien fehlt dem menschlichen Körper der „Treibstoff“: Innerhalb der Zellen verwandeln Mitochondrien Fette und Kohlehydrate aus der Nahrung in die körpereigene Energiewährung Adenosintriphosphat (ATP). Ist der zelluläre Stoffwechsel gestört, kann dies schwerwiegende Erkrankungen zur Folge haben. Eine davon ist das mütterlich vererbte Leigh-Syndrom, abgekürzt MILS. Bei dieser seltenen Erkrankung beeinträchtigt eine Mutation des Gens MT-ATP6 auf der mitochondrialen DNA (Desoxyribonukleinsäure) den Stoffwechsel in der Zelle und damit das zentrale Nervensystem (s. Kasten). Das Leigh-Syndrom, bei dem im schlimmsten Fall ganze Hirnareale absterben, kann derzeit weder wirkungsvoll behandelt noch geheilt werden. Die der Krankheit zugrunde liegenden Mechanismen sind noch nicht vollständig entschlüsselt. Ein wesentliches Hindernis dabei ist der Mangel an Modellsystemen, mit denen sich der Krankheitsverlauf bei Menschen nachstellen lässt.
Maternal Inherited Leigh-Syndrom (MILS)
Das über die Mutter vererbte Leigh-Syndrom (englisch: Maternal Inherited Leigh-Syndrom, MILS) ist eine seltene, genetisch bedingte und fortschreitende Erkrankung des Zentralnervensystems, die auf eine Störung des mitochondrialen Stoffwechsels zurückgeht. MILS tritt bei etwa einem von 100.000 Neugeborenen auf; oft leiden Betroffene schon ab der Geburt an Symptomen wie Muskelschwäche, Epilepsie, Hör- und Sehstörungen und einer schwerwiegenden Entwicklungsstörung. Manifestiert sich die Krankheit erst später, kann es schon bei vermeintlich banalen Infekten zu einer Stoffwechselkrise mit Übersäuerung des Blutes bis hin zum Koma kommen. Die Lebenserwartung von Betroffenen beträgt meist nur wenige Jahre.
Mit der Reprogrammierung von Körperzellen hofft die Wissenschaft, einer Therapie und sogar Heilung des Leigh-Syndroms einen großen Schritt näher zu kommen. Dazu nutzen Forschende des vom Bundesministerium für Bildung und Forschung (BMBF) geförderten Verbundes CureMILS Hautzellen von Patientinnen und Patienten, die in sogenannte induzierte pluripotente Stammzellen (iPSC) „umgewandelt“ werden und sich im Labor dann zu verschiedenen neuronalen Zellen differenzieren lassen. „Die von uns erzeugten menschlichen Nervenzellmodelle eignen sich zur Erforschung des Leigh-Syndroms wesentlich besser als Tiermodelle, denen die entsprechende DNA-Mutation fehlt“, erläutert Professor Dr. Alessandro Prigione von der Düsseldorfer Heinrich-Heine-Universität, der Leiter des CureMILS-Konsortiums.
Den Mangel an effektiven Modellsystemen wollen die Forschenden aber auch überwinden, indem sie versuchen, Patientenzellen direkt in neuronale Zellen umzuprogrammieren. Mit solchen induzierten neuronalen Stammzellen ließe sich der zeitaufwendige Prozess der Gewinnung von iPSC wesentlich verkürzen. „Die reprogrammierten neuronalen Zellen lassen sich weiter in 2-D- und 3-D-Modellsysteme differenzieren“, erläutert Dr. Ole Pless vom Fraunhofer-Institut für Translationale Medizin und Pharmakologie (ITMP), zuständig für ein Teilprojekt bei CureMILS. „Dank verfeinerter Differenzierungstechnologien lassen sich Nervenzellkulturen und sogenannte Hirnorganoide herstellen, an denen sich die Wirkung von Arzneimitteln auf bei MILS-Patienten besonders betroffene Gehirnareale nachvollziehen und bewerten lässt.“
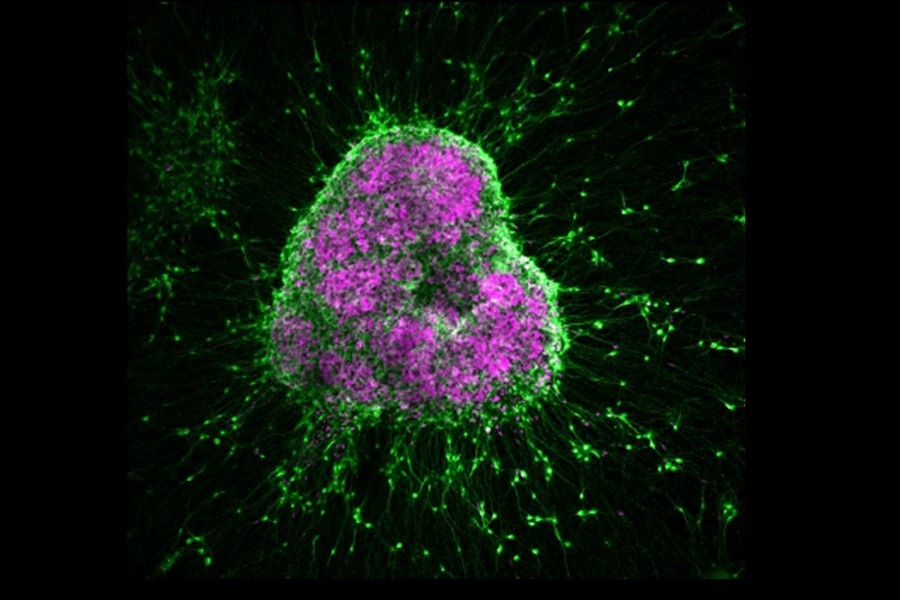
Hirnorganoide, die in vitro aus menschlichen induzierten pluripotenten Stammzellen gewonnen wurden (grün: neuronaler Marker MAP2; violett: neuraler Vorläufer-Marker SOX2)
© Stephanie Le
Hochdurchsatz-Screening liefert hochwertige „Wirkstoffbibliothek“
Mit reprogrammierten Nervenzellen haben Prigione und seine Verbundpartner ein groß angelegtes Screening durchgeführt. Im Hochdurchsatzverfahren haben sie mehr als 5.500 Wirkstoffe getestet, für die bereits umfangreiche Sicherheits- und Wirksamkeitsdaten vorhanden sind, und in einer qualitativ hochwertigen „Substanzbibliothek“ zusammengeführt. Der als Repurposing oder Repositionierung bezeichnete Einsatz bereits zugelassener Medikamente könnte auch MILS-Patientinnen und -Patienten schnell wirksame Hilfe bringen und den mitochondrialen Stoffwechsel normalisieren, denn gentherapeutische Behandlungsansätze liegen laut Prigione noch in weiter Ferne.
Einer der bei CureMILS getesteten Wirkstoffe ist Sildenafil, das unter der Bezeichnung Viagra® zur Behandlung von Erektionsstörungen zugelassen ist. Auch bei Kindern ist die Sicherheit des Wirkstoffs bereits bekannt und gut erforscht. „In der Kinderheilkunde ist Sildenafil zur Behandlung von Lungenhochdruck bei Säuglingen zugelassen“, sagt Prigione. „Wir konnten zeigen, dass der Wirkstoff einen positiven Einfluss auf den intrazellulären Kalziumstoffwechsel und die Wachstumsfähigkeit der Nervenzellen von MILS-Patienten hat.“
Professor Dr. Alessandro Prigione
© Stephanie Le
Individuelle Therapieerfolge bestätigen den Ansatz der Forschenden
Zeitlich parallel zu diesen Untersuchungen im Forschungslabor betreute Dr. Markus Schülke, Professor für Experimentelle Neuropädiatrie an der Berliner Charité, einen jugendlichen MILS-Patienten, der nach einer Stoffwechselkrise mit einer Herz- und Muskelschwäche und epileptischen Anfällen über mehrere Wochen im Koma lag und intensivmedizinisch behandelt werden musste. Nach Abwägung aller Risiken und gemeinsam mit den Eltern entschlossen sich die behandelnden Ärzte zu einem Therapieversuch mit Sildenafil.
Der Erfolg gab den Klinikern recht: „Der Patient hat sich unter der Therapie rasch erholt, konnte wieder selbst atmen und sich bewegen“, berichtet Schülke. Weitere individuelle Therapieversuche bei zwei Kindern und zwei Erwachsenen mit einer hohen Mutationslast für eine MT-ATP6-Mutation wurden in Düsseldorf, Berlin, München und Bologna durchgeführt. Alle Patienten haben Sildenafil laut Schülke gut vertragen und von der Behandlung profitiert.
Basierend auf den präklinischen und klinischen Daten hat die Europäische Arzneimittelagentur (EMA) inzwischen gemäß der Orphan Drug Designation (ODD) genehmigt, Sildenafil zur MILS-Therapie einzusetzen – ein entscheidender Schritt, damit auch weitere Betroffene von der Behandlung profitieren können. Zur klinischen Prüfung der Wirkung von Sildenafil plant das Konsortium eine europaweite multizentrische Studie.
Professor Dr. Markus Schülke
© Charité − Universitätsmedizin Berlin
Translation: Aus dem Labor zu Patientinnen und Patienten
Die Arbeiten im CureMILS-Verbund reichen damit weit über Grundlagenforschung hinaus. Sie haben dargelegt, dass es bereits zahlreiche Medikamente auf dem Markt gibt, die bei seltenen Erkrankungen helfen können und eine schnelle Translation von Forschungsergebnissen aus dem Labor zu den betroffenen Patientinnen und Patienten ermöglichen. „Wir haben gleichsam eine „Forschungspipeline“ für die Repositionierung von Medikamenten zur Verfügung gestellt und gezeigt, dass die parallele Untersuchung umfangreicher Substanzsammlungen wesentlich schneller zu Ergebnissen führen kann, als dies in der Vergangenheit der Fall war“, bilanziert Alessandro Prigione. „Zudem weisen die von uns entwickelten Krankheitsmodelle nicht nur den Weg zu einer wirksamen Behandlung von MILS – dieser Ansatz könnte auch auf andere seltene und bisher unheilbare Erkrankungen anwendbar sein.“
Dr. Ole Pless
©Martin Kunze
CureMILS Konsortium
Das CureMILS-Konsortium vereint Grundlagenforschende, Klinikerinnen und Kliniker aus Deutschland, Österreich, Finnland, den Niederlanden, Luxemburg, Polen und Italien sowie Patientenorganisationen und Partner aus der Industrie. Das Bundesministerium für Bildung und Forschung (BMBF) unterstützt die Arbeiten des von Professor Alessandro Prigione geleiteten Forschungsverbundes über das European Joint Programme on Rare Diseases (EJP RD). In den Jahren 2021 bis 2024 werden hierfür knapp 830.000 Euro bereitgestellt; für den Verbund grundlegende Arbeiten förderte das BMBF von 2015 bis 2019 über die von Prigione geleitete Nachwuchsgruppe „System-iPS“ mit rund 1,4 Millionen Euro.
Erforschung Seltener Erkrankungen
Eine Erkrankung gilt dann als selten, wenn nicht mehr als fünf von 10.000 Menschen von ihr betroffen sind. „Selten“ sind diese Erkrankungen in ihrer Gesamtheit jedoch nicht − mehr als 6.000 Seltene Erkrankungen sind bekannt.
Das Bundesministerium für Bildung und Forschung (BMBF) unterstützt die Erforschung der Seltenen Erkrankungen seit 2003 mit erheblichen finanziellen Anstrengungen: So wurden 144 Millionen Euro in nationale Forschungsverbünde investiert, die sich sowohl der Grundlagenforschung als auch der klinischen Forschung widmen. Eine aktuelle Förderrichtlinie hat bereits bestehenden Verbünden die Möglichkeit eröffnet, für weitere drei Jahre Fördergelder zu erhalten. Hier werden neun Verbünde von 2022 bis 2027 mit rund 21,5 Millionen Euro gefördert.
Die Stärkung der internationalen Zusammenarbeit ist gerade bei der Erforschung Seltener Erkrankungen von hoher Bedeutung: Dank höherer Patientenzahlen sowie gemeinsam genutzter Ressourcen und Infrastrukturen lassen sich validere Erkenntnisse gewinnen. Daher beteiligen sich das BMBF und die Deutsche Forschungsgemeinschaft (DFG) seit 2019 an dem von der EU geförderten und bis 2024 laufenden European Joint Programme on Rare Diseases (EJP RD). Hier werden 65 internationale Projekte mit über 100 Millionen Euro gefördert, an denen sich das BMBF mit 15 Millionen Euro beteiligt. Darüber hinaus beteiligt sich das BMBF am International Rare Diseases Research Consortium (IRDiRC).
Weitere Informationen:
www.research4rare.de
www.ejprarediseases.org
irdirc.org
Ansprechpersonen:
Prof. Dr. Alessandro Prigione
Klinik für Allgemeine Pädiatrie, Neonatologie und Kinderkardiologie
Universitätsklinikum und Medizinische Fakultät
Heinrich-Heine-Universität Düsseldorf
Moorenstraße 5
40225 Düsseldorf
E-Mail: Alessandro.Prigione@med.uni-duesseldorf.de
Dr. Ole Pless
Fraunhofer-Institut für Translationale Medizin und Pharmakologie ITMP
Schnackenburgallee 114
22525 Hamburg
E-Mail: ole.pless@itmp.fraunhofer.de
Prof. Dr. Markus Schülke
Klinik für Pädiatrie mit Schwerpunkt Neurologie
Exzellenzcluster NeuroCure
Charité – Universitätsmedizin Berlin
Augustenburger Platz 1
13353 Berlin
E-Mail: markus.schuelke@charite.de